 | | 2019년 9월 진양곤 에이치엘비 회장의 리보세라닙 글로벌 3상 임상 전체 데이터 공개 (사진=유투브 캡처) |
|
[이데일리 노희준 기자]
에이치엘비(028300)발 쇼크로 제약 바이오업계가 얼어붙은 가운데 업계와 전문가들 사이에서는 금융당국 조사 결과와 관계없이 에이치엘비가 임상 결과 발표에 좀더 신중했어야 한다는 의견이 나온다. 회사가 입증하겠다고 설정한 1차 평가지표(주평가지표)가 충족되지 않은 임상을 2차 지표(부평가지표)를 내세워 단정적으로 ‘성공했다’고 발표했다는 지적이다.
17일 제약 바이오업계에 따르면, 에이치엘비는 개발 중인 항암 신약 후보물질 ‘리보세라닙’의 글로벌 임상 3상 결과를 자의적으로 해석해 허위 공시한 혐의로 금융당국 조사를 받았다. 금융당국은 3개월 만에 회사의 임상 3상 발표 내용이 바뀐 것에 주목한 것으로 알려졌다.
에이치엘비는 2019년 6월 톱라인(주요지표) 발표를 통해 “이번 임상결과치로는 (FDA) 허가신청이 쉽지 않을 것으로 판단된다”고 밝혔다. 회사는 그 근거로 유효성 1차 평가지수인 OS(전체생존기간)가 통계적 유의성에 도달하지 못한 점을 들었다. 임상에서 1차 지표란 회사가 사전에 해당 임상을 통해 입증하겠다고 설정한 변수를 말한다. ‘회사가 승부를 보겠다’는 지표에서 목표를 달성하지 못했다는 얘기다. OS란 약을 투여한 후 환자가 생존하는 전체기간을 말하며 통상 항암제에서 가장 대표적인 1차 지표로 사용된다. 통계적 유의성을 갖는다는 것은 임상 결과가 우연이나 실수에 의해 나온 게 아니라 신뢰할 만하다는 뜻이다.
 | | 리보세라닙 3차 임상 디자인 |
|
FDA 허가 신청이 어렵다던 에이치엘비는 3개월 뒤인 같은해 9월에 같은 글로벌 임상 3상을 두고 “최종 데이터를 확정 및 분석한 결과 성공했다”고 다른 입장을 내놨다. 최종 데이터를 집계 및 분석해보니 1차 지표인 OS가 통계적 유의성을 달성하지 못한 것은 변함이 없지만 나머지 데이터가 모두 탁월했다는 이유에서다.
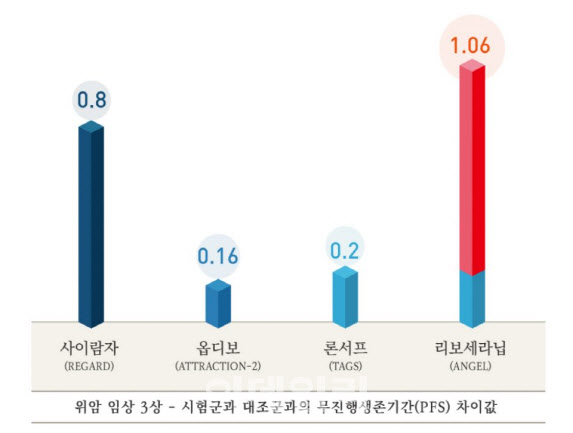
특히 2차 지표 중에서도 무진행생존기간(PFS)에서 후보물질인 리보세라닙이 경쟁약물보다 월등한 약효를 입증했다고 밝혔다. 시험군과 대조군의 무진행생존기간 차이에서 리보세라닙 1.06개월, 다른 항암제 론서프 0.2개월, 또다른 항암제 옵디보 0.16개월로 결과가 나왔다는 것이다. PFS는 약물 투여 후 암이 커지거나 전이되지 않는 등 종양 상태가 악화되지 않은 기간을 말한다. 리보세라닙을 투여한 환자가 가짜약을 투여한 환자보다 종양이 악화되지 않은 기간이 1.06개월 더 길었다는 얘기다.
전문가들은 이 과정에서 에이치엘비가 임상 결과를 더 보수적으로 발표했어야 한다는 지적을 내놓는다. 우선 2019년 9월 발표에서 임상 3상을 성공했다고 밝힌 것이 도마에 오른다. 한 대학병원의 임상 전문가(종양내과 교수)는 “1차 지표가 OS인 상황에서 OS를 미충족했다는 것은 실패한 것”이라며 “이런 경우에 2차 지표인 PFS가 충족돼 성공한 임상이라고 표현해서는 안된다”고 잘라말했다.
 | | (자료=에이치엘비 홈페이지) |
|
물론 1차 지표에서 통계적 유의성을 달성하지 못해도 2차 지표 등으로 FDA가 허가를 내준 경우가 전혀 없는 것은 아니다. 에이치엘비는 2019년 9월 발표에서도 “얀센의 항암제인 트라벡테딘(상품명 욘델리스)은 임상 3상 결과 전체생존기간이 통계적 유의성을 확보하지 못했지만, 무진행생존기간이 통계적 유의성을 확보, 2015년 10월 신약허가를 받은 바 있다”고 소개하기도 했다.
하지만 이런 경우는 드물다는 게 전문가들의 공통된 견해다. 때문에 설사 유의미하다고 판단한 2차 지표 성과를 내세울 때도 더 주의했어야 한다는 조언이다. 한 임상 디자인 및 컨설팅 전문가(보건통계학 박사)는 “1차 지표에서 실패했더라도 추가적인 분석을 통해 2차 지표의 유의미성에 대해 발표는 할 수 있다”며 “하지만 그때도 그걸로 임상이 성공했다고 발표해서는 안 된다”고 강조했다. 금융당국도 지난해 2월 코스닥시장 제약·바이오 기업의 공시 투명성 제고를 위한 가이드라인 발표를 통해 임상시험 결과를 두고 기업이 ‘임상 성공’이라는 표현을 쓰지 못하도록 했다.
 | | 금융당국의 코스닥시장 제약·바이오 기업 공시 가이드라인 내용 (자료=금융당국) |
|
회사가 임상 조건이 다른 경쟁 약물의 임상과 비교하면서 우월성을 주장하는 것도 회사 신뢰를 떨어트린다는 지적도 나온다. 한 바이오업체 대표는 “임상 디자인이 다르기에 가급적 비교를 하지 않는 게 좋다. 직접 비교 임상이 아닌데 비교하는 것은 미스리딩(오도)하는 것”이라며 “(투자자의) 엄청난 돈이 걸려 있는 상황에서 발표를 굉장히 조심스럽게 했어야 했는데 ‘임상이 성공했고 허가를 내겠다’고 너무 앞서 갔다”고 말했다.
에이치엘비 관계자는 “‘임상이 성공했다’고 한 것은 회사 자체만의 판단은 아니었다”며 “내외부의 과학자 집단과 미국 FDA 전문 컨설팅 법무법인(코빙턴)등 전문가 집단의 의견을 수렴해서 발표한 것”이라고 반박했다. 아울러 경쟁 약물과의 단순 비교 설명에 대해서는 “임상 연구를 전문적으로 설명해주면 주주들은 잘 모른다”면서 “약이 이렇게 잘 작동했다는 것을 알기 쉽게 설명하기 위한 것이었다”고 설명했다.
전문가들은 2차 지표를 내세워 FDA 허가를 받으려면 통상 임상을 다시 해야 한다고 봤다. 신약개발에 정통한 한 벤처캐피탈(VC) 대표는 “암 특성에 따라 PFS 지표로 승인을 내주는 경우가 없지 않다”면서도 “이 경우에도 1차 지표를 PFS로 잡아 환자모집도 새로 하고 새로운 임상을 통해 PFS에서 통계적 유의성을 입증해야 한다”고 말했다. 이와 관련 에이치엘비 관계자는 FDA와의 신약허가 신청 전 사전미팅에서 임상 재실시에 대한 권고를 받지 않았느냐는 질문에 “기밀사항이라 코멘트 하기 어렵다”며 “(FDA는) 보완해야 할 사항을 말해줘 그에 대해 준비 중”이라고만 했다.












