[이데일리 김진수 기자] 한 주(12월 4일~12월 8일) 국내 제약·바이오 업계에서 주목받은 임상이다.
큐라클 궤양성 대장염 치료제 유럽 IND 승인 큐라클은 궤양성 대장염 치료제 후보물질 ‘CU104’ 임상 2상 임상시험계획(IND)을 유럽 3개국의 의약품 규제기관에서 승인 받았다고 8일 공시했다.
큐라클은 CU104 글로벌 임상 추진 계획에 따라 지난 6월 미국 식품의약국(FDA) IND 승인에 이어 유럽 3개국 의약품 규제기관에서 IND 승인 받았다. 이후 한국에서도 임상을 승인받아 내년부터는 본격적인 글로벌 임상을 시작할 예정이다.
CU104 임상 2상은 중등도 또는 중증의 궤양성 대장염 환자 45명을 대상으로 8주간 진행된다. 무작위 배정, 이중 눈가림, 위약 대조 방식으로 약물의 유효성과 안전성을 평가할 예정이다.
큐라클 관계자는 “글로벌 임상을 통해 각국의 규제 요구 사항 충족에 필요한 데이터 수집이 가능할 것”이라며 “FDA 자문위원 및 국내 의료진의 자문과 서울대학교 약학대학과의 협업 등 약물개발에 만반의 준비를 했다”고 말했다.
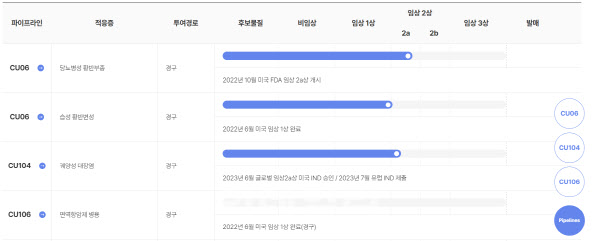 | | 큐라클 파이프라인. (사진=큐라클) |
|
보로노이, 폐암치료제 VRN11 대만 임상시험계획 승인 신청 보로노이가 비소세포폐암(NSCLC) 치료제 VRN11 임상시험계획(IND)을 대만 식품의약품청(TFDA)에 신청했다고 6일 공시했다.
보로노이는 TFDA의 IND 승인 직후 대만 내 2개 대형병원에서 비소세포폐암 환자를 대상으로 임상을 진행할 예정이다. 앞서 지난달 한국 식품의약품안전처로부터 임상 시험계획 승인을 받은 보로노이는 내년에 미국 FDA IND를 진행해서 1b 임상부터는 미국 병원도 본격적으로 참여시킬 계획이다.
보로노이는 이번 임상을 통해 타그리소 등 기존 EGFR(상피세포성장인자수용체) 돌연변이 비소세포폐암 치료제에 대한 약물 내성으로 발생하는 EGFR C797S 변이 암 환자에 대한 VRN11 효과를 확인할 것으로 기대하고 있다.
전임상 시험에서 VRN11은 EGFR C797S 변이 뿐만 아니라 L858R, Del19 등 원발암을 포함한 다양한 EGFR 변이와 관련해 뛰어난 효능과 낮은 독성, 100%에 이르는 뇌투과도를 보여준 바 있다.
김대권 보로노이 연구부문 대표는 “기존 치료제의 한계를 뛰어넘는 VRN11임상 개발을 차질없이 진행해 많은 비소세포폐암 환우와 가족들이 하루라도 빨리 고통과 부담에서 벗어날 수 있도록 최선을 다하겠다”고 밝혔다.
아미코젠 자회사, 식약처에 황반변성치료제 임상 3상 신청 아미코젠 관계사 로피바이오가 식품의약품안전처에 황반변성치료제 아일리아의 바이오시밀러 임상 3상 시험을 신청했다고 4일 밝혔다.
로피바이오의 아일리아 바이오시밀러는 오리지널 의약품과 효능이 동등하면서 경쟁사 대비 최대 3~4배 달하는 높은 생산성으로 인해 가격경쟁력을 갖추고 있는 것으로 알려졌다. 이를 바탕으로 식약처에 임상 3상 승인을 신청했다. 또 미국, 유럽 등에서도 임상을 진행해 본격적으로 아일리아 바이오시밀러 시장에 진출할 계획이다.
로피바이오는 2025년까지 임상을 완료하고 이어 국내, 미국, 유럽 등에 판매 허가를 신청할 예정이다.
황반변성은 황반의 퇴행성 변화가 주원인으로 75~84세 인구의 약 30%에서 발병되는 대표적인 노인성 질환이다. 황반변성치료제 시장은 2020년 89억달러로 추산되고 2028년에는 187억달러에 육박할 것으로 전망된다.
로피바이오는 국내 정상급 CRO 업체 ‘씨엔알리서치’와 글로벌 임상 3상을 진행한다. 아울러 미국 FDA와 BPD 타입2 미팅(Type2 meeting)을 비디오 콘퍼런스(Video conference)로 진행할 예정이다.
로비바이오 관계자는 “비디오 콘퍼런스를 통해 미팅을 진행한다는 것은 FDA에서 로피바이오 파이프라인에 관심이 많아 정확한 가이드를 제공하겠다는 것을 의미한다”고 해석했다.
홍승서 로피바이오 대표는 “향후 수백조원에 이르게될 바이오시밀러 시장에 진출하기 위한 준비가 계획대로 진행되고 있다”며 “아미코젠그룹의 세포배양용 배지와 정제용 레진의 개발, 그리고 생산시설의 건설과 함께 로피바이오가 바이오시밀러 사업에 진출함으로써 아미코젠과 빠른 시일내 바이오의약품 생산 수직계열화 완성할 것“이라고 강조했다.



![[임상 업데이트] 아이진, 수막구균 4가 백신 임상 2·3상 승인](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25070500058b.jpg)

![[용호상박 K바이오]'안 아프게 맞자'…메디허브·라메디텍](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25070400668b.jpg)



![[단독] 헥토그룹, 개인정보법 규정 위배 논란...당국, 불법 스크래핑 전수 조사한다](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25070400788b.jpg)