팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 나은경 기자] 비소세포폐암(NSCLC) 1차 치료제로 가장 많이 쓰이는 ‘타그리소’(성분명 오시머티닙) 내성 환자 대상 신약을 개발하기 위한 글로벌 경쟁이 달아오르고 있다. 경쟁이 치열한 이 시장에서 국내 기업
브릿지바이오테라퓨틱스(288330)가 선두로 올라섰다. 현재 임상 1/2상 중인 BBT-176에 이어 올 상반기 BBT-207 임상 1/2상 개시까지 노리면서다. 브릿지바이오는 기세를 몰아 연내 두 파이프라인을 묶은 조 단위 패키지딜 기술이전에 성공하겠다는 목표다.
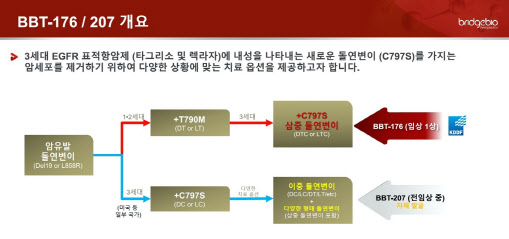
10년 뒤 6.3조 시장, 브릿지바이오 선두로 ‘우뚝’ 2일 제약·바이오업계에 따르면 올 초 브릿지바이오는 미국 식품의약국(FDA)에 BBT-207의 1/2상 임상시험계획(IND)을 신청할 계획이다. 계획대로 일정이 진행된다면 브릿지바이오는 C797S 삼중 돌연변이 EGFR 저해제 분야에 이어 C797S 이중 돌연변이 분야에서도 개발 속도에서 선두를 지키게 된다. 현재 타그리소 내성으로 발생하는 C797S 이중 및 삼중 돌연변이 치료제는 미개척지로 국내외 신약개발사들이 모두 혁신치료제(first-in-class) 자리를 노리고 있다.
 | | (자료=브릿지바이오테라퓨틱스) |
|
폐암은 비소세포폐암과 소세포폐암으로 구분되는데, 비소세포폐암의 환자가 80%로 압도적이다. 이중 상피세포 성장인자 수용체(EGFR)를 타깃으로 하는 비소세포폐암 표적치료제는 △1세대 이레사·타쎄바 △2세대 지오트립·비짐프로 △3세대 타그리소·렉라자로 분류된다. C797S는 타그리소 복용으로 생기는 돌연변이다. 비소세포폐암 환자가 타그리소를 1차 치료제로 복용했다면 C797S 이중 돌연변이가, 1·2세대 치료제 복용 후 타그리소를 복용했다면 C797S 삼중 돌연변이가 발생한다.
비소세포폐암 환자 중 35%에서 EGFR 돌연변이가 나타나고 C797S 돌연변이는 그중에서도 26%를 차지하는 것으로 알려져 있다. 비소세포폐암은 2032년 글로벌 시장 규모가 570억 달러(72조억원)로 예상되는데, 단순계산하면 C797S 돌연변이 시장은 10년 뒤 약 50억 달러(6조3000억원) 규모가 되는 셈이다. 3·4차 치료제 약가는 보통 1·2차 치료제보다 높게 책정되기 때문에 실제 시장규모는 이보다 더 클 것이라는 분석도 나온다.
아직까지는 삼중 돌연변이 시장이 더 크지만 앞으로 렉라자가 1차 치료제로 인정되면 C797S 이중 돌연변이 시장이 더 커질 거라는 게 업계 예상이다. 3세대 치료제인 렉라자 역시 타그리소와 마찬가지로 복용 후 C797S 돌연변이가 발생할 것으로 예상되고 있어서다.
패키지 L/O된 BLU-945 탈락 희소식...브릿지바이오도 L/O 속도 시장 성장세가 높은 만큼 해외 신약개발사들도 C797S 돌연변이를 타깃으로 한 치료제 개발에 열을 올리고 있지만 임상 진행 속도는 브릿지바이오보다 느리거나 비슷한 수준이다.
블랙다이아몬드테라퓨틱스는 기존에 난치성 뇌종양(교모세포종) 치료제로 개발 중이던 ‘BDTX-1535’의 적응증을 지난해 비소세포폐암 C797S 돌연변이 EGFR 저해제까지 확장했다. BDTX-1535는 지난해 1월 FDA로부터 IND 승인을 받은 데 이어 지난해 8월에는 한국 식품의약품안전처(식약처)로부터 IND를 승인받고 현재 임상 1상을 진행 중이다. BDTX-1535가 C797S 돌연변이 중 어떤 것을 타깃으로 할지는 아직 공개되지 않았다. 만약 삼중 돌연변이를 타깃으로 한다면 BBT-176보다 15개월 개발 속도가 느린 것이고, 이중 돌연변이를 타깃으로 한다면 BBT-207보다 1년가량 개발 속도가 빠른 것으로 볼 수 있다.
 | | 블루프린트메디슨스는 지난달 ‘BLU-945’를 타그리소 병용약물로 개발, 기존 개발 전략을 선회한다고 밝혔다. (자료=블루프린트) |
|
BBT-176의 가장 강력한 경쟁물질로 꼽히며 중국 자이랩으로 기술이전됐던 블루프린트메디슨스의 BLU-945는 사실상 경쟁레이스에서 탈락했다. 지난해 11월 임상 1상에서 단독요법 효능에 한계를 확인하면서 타그리소 병용 전략으로 방향을 틀겠다고 발표하면서다. 해당 내용이 발표된 직후 블루프린트의 주가는 4일간 19% 빠졌고, 이후 소폭의 등락을 거듭했지만 계속 그 자리에 머문 상태다. 반면 블루프린트의 개발전략 변경으로 BBT-176은 C797S 삼중 돌연변이 EGFR 저해제 시장에서 개발 속도 1위를 탈환했다.
블루프린트는 대신 C797S 이중 돌연변이 EGFR 저해제인 ‘BLU-525’를 새로 공개했다. 회사 측은 현재 BLU-525가 전임상 단계로 올해 1분기 중 IND를 신청하겠다고 밝혔지만 발표한 타임라인은 무리라는 해석이 나온다. BLU-701에서 BLU-525로 개발물질이 전격 교체된 만큼 데이터 확보에 시간이 소요될 수 있다는 이유에서다.
브릿지바이오는 올해 JP모건 헬스케어 콘퍼런스에서 BBT-207을 포함한 주요 파이프라인의 개발 계획을 발표할 예정이다. 회사는 앞서 중국 자이랩이 블루프린트의 C797S 삼중 돌연변이(BLU-945)와 이중 돌연변이 타깃 치료제(BLU-701)의 중화권 시장의 권리를 7200억원 규모로 함께 기술이전 해간 선례를 들며 연내 수조원 규모의 BBT-176과 BBT-207의 패키지 딜 가능성을 기대하고 있다.
임종진 브릿지바이오 경영전략본부장(부사장)은 “차세대 EGFR 표적치료제 시장에서 브릿지바이오와 양강 구도로 임상시험을 진행했던 블루프린트의 개발 전략이 대폭 수정, 지연됨에 따라 BBT-176과 BBT-207의 가치는 더 부각될 것”이라며 “사업개발에 있어서 더 유리한 조건을 이끌어 내 의미있는 결과를 도출할 수 있도록 최선을 다하겠다”고 말했다.





![[용호상박 K바이오]'안 아프게 맞자'…메디허브·라메디텍](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25070400668b.jpg)


![[임상 업데이트] 아이진, 수막구균 4가 백신 임상 2·3상 승인](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25070500058b.jpg)

![[단독] 헥토그룹, 개인정보법 규정 위배 논란...당국, 불법 스크래핑 전수 조사한다](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25070400788b.jpg)