[이데일리 김명선 기자] 삼성바이오에피스가 올 6월 황반변성 신약 ‘루센티스(라니비주맙)’의 첫 바이오시밀러(바이오 복제약) 미국 출시를 앞뒀다. 1조8000억원 규모 시장이다. 루센티스를 개발한 로슈 자회사 제넨텍(Genentech)은 약효 반감기를 늘린 치료제를 내놨다. 가격이 더 저렴한 바이오시밀러로 처방이 전환되는 사례를 막겠다는 전략으로 풀이된다.
오리지널사, 투약 주기 늘린 치료제로 대응 루센티스는 제넨텍이 개발하고 로슈(Roche)와 노바티스(Novartis)가 판매 중인 황반변성 치료제다. 황반변성은 망막 중심부에 있는 황반이 손상돼 중심시력이 저하되는 질환이다. 선진국에서 노인 실명 원인 1위 질환으로 꼽힌다. 루센티스는 최초의 황반변성 치료제다. 지난해 6월 미국 내 물질 특허가 만료됐고, 올해 1월 유럽 특허가 끝났다.
 | | 황반변성은 망막 중심부에 있는 황반이 손상돼 중심시력이 저하되는 질환이다. (사진=픽사베이) |
|
아직 전 세계적으로 출시된 루센티스 바이오시밀러는 없지만, 곧 상황이 달라진다. 삼성바이오에피스는 6월 바이오시밀러 ‘바이우비즈’를 미국에 선보일 예정이다. 삼성바이오에피스가 미국 식품의약국(FDA)으로부터 바이오비즈 품목허가를 받은 건 지난해 9월이다. 다만 제넨텍과 라이선스 계약에 따라 미국에서 제넨텍 의약품 추가보호 증명(SPC)이 만료되는 올 6월부터 제품을 판매하기로 했다.
삼성바이오에피스가 진출하는 루센티스 글로벌 시장은 2020년 기준 4조원 규모다. 그중 미국 매출은 1조8000억원 정도다. 루센티스가 속한 황반변성 치료제 시장 전망은 긍정적이다. 데이터 분석기관 글로벌데이터(Glovaldata)에 따르면, 2028년까지 9개 주요국(미국·EU5·일본·중국·호주) 황반변성 치료제 시장 규모는 2018년 두 배인 187억달러(약 22조3820억원)에 달할 것으로 예상된다.
바이오시밀러 등장이 예고되면서 오리지널사도 대응에 나섰다. 제넨텍은 안구에 삽입하는 형태의 황반변성 치료 임플란트 ‘서스비모(Susvimo)’를 지난해 10월 FDA에서 허가받았다. 당시 로슈는 수개월 내에 미국 시장에서 서스비모를 공급하겠다고 밝혔다. 3일 나온 로슈 IR 자료에 따르면, 서시비모는 출시돼 지난해 100만 프랑(약 13억원) 매출을 냈다.
수술을 통해 이식된 서스비모는 루센티스 100mg/mL을 안구에 지속해서 전달한다. 11일 로슈는 임상 3상 2년 데이터를 발표하며 “노인성 황반변성 환자가 6개월마다 서스비모를 리필하거나 매달 루센티스 0.5mg을 투약받은 결과, 환자가 시력을 유지했으며 매달 루센티스 주사로 치료받은 환자군과 비교해 비열등한 것으로 나타났다”고 설명했다.
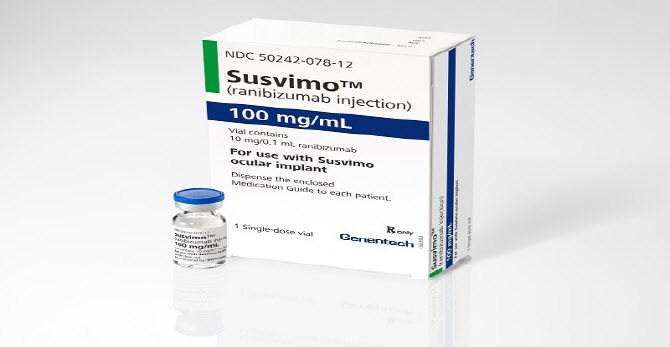 | | 제넨텍은 안구에 삽입하는 형태의 황반변성 치료 임플란트 ‘서스비모(Susvimo)’를 내놓았다. (사진=로슈) |
|
서스비모 장점은 ‘편의성’이다. 루센티스로 치료를 하던 환자는 한 달에 한 번 안구에 주사를 맞으러 병원에 가야한다. 서스비모에는 6개월간 사용할 수 있는 라니비주맙 저장소가 들어 있다. 반 년에 한 번 임플란트를 충전하면 된다. 투여 빈도가 1년에 12회에서 2회로 줄어든 셈이다.
제약업계 관계자는 “오리지널사는 특허 만료를 염두에 두고, 전임상 때부터 제형을 바꾸는 등 기술적인 부분을 고려한다. (서스비모는) 환자의 편익 면에서 바이오시밀러나 오리지널약보다 더 처방될 가능성도 있다. 병원에서 의사와 환자가 얼마나 선호하는지에 성패가 달렸다”고 설명했다.
업계에서는 서스비모의 ‘안전성’이 처방 확대의 관건이라는 이야기도 나온다. 임상 3상에서 서스비모는 루센티스와 비교했을 때 내안구염 발생 위험이 3배 더 높은 것으로 나타났다. 특히 안구에 직접 주사하는 황반변성 치료제 시장은 안전성에 더욱 예민하다는 게 업계 이야기다. 노바티스 황반변성 주사제 ‘비오뷰(Beovu)’는 3개월로 투약 주기를 늘렸지만, 부작용 논란이 일며 2020년 매출이 1억9000만달러(약 2274억원)에 그쳤다.
 | | 삼성바이오에피스 ‘바이우비즈’는 올 6월 미국 시장에 출시될 예정이다. (사진=삼성바이오에피스 제공) |
|
동등한 효과 대비 가격경쟁력…“바이오젠과 협력 기대” 삼성바이오에피스 바이우비즈도 루센티스와 똑같이 1년에 12번 맞아야 한다. 다만 바이우비즈는 바이오시밀러라 오리지널약과 동등한 효과를 내면서도 가격경쟁력을 갖출 수 있다. 국내에서 루센티스는 1바이알(병)당 약제 급여상한액이 약 83만원으로 알려졌다. 미국의 경우 가격은 더 비싸다.
바이오 업계 관계자는 “투약 주기를 늘린 서스비모가 나왔다고 바이오시밀러 시장이 잠식된다고 보기에는 무리가 있다. 의사의 판단에 따라 병원이 멀리 있는 등의 이유로 1달에 1번씩 맞기 어려운 사람들에게 제한적으로 처방될 가능성이 있다”며 “서스비모는 안전성 부분에서 좀 더 검증이 필요해 얼마나 처방될지는 지켜볼 필요가 있다”고 밝혔다.
삼성바이오에피스는 가격경쟁력과 마케팅 경험을 앞세워 시장을 침투한다는 입장이다. 삼성바이오에피스 관계자는 “기존에 협력해온 바이오젠(Biogen)이 바이우비즈 판매를 맡는다. 2016년부터 바이오젠과 유럽에서 자가면역질환 치료제에 대해 협력해왔는데, 누적 처방 환자 수가 24만 명 이상이다. 경험을 살려 미국에서도 협력을 강화해나갈 예정”이라고 말했다.





![[임상 업데이트] 아이진, 수막구균 4가 백신 임상 2·3상 승인](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25070500058b.jpg)

![[용호상박 K바이오]'안 아프게 맞자'…메디허브·라메디텍](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25070400668b.jpg)



![[단독] 헥토그룹, 개인정보법 규정 위배 논란...당국, 불법 스크래핑 전수 조사한다](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25070400788b.jpg)