2022년 한 해 동안 진행됐던 ‘블록버스터 톺아보기 파트1’은 3년 전인 2020년 세계에서 가장 많이 팔린 의약품 1~55위를 차례로 다뤘다. ‘블록버스터 톺아보기 파트2’는 2022년~2023년 사이 새롭게 10억 달러 이상 매출을 올렸거나 3~4년 내로 그에 상응하는 매출을 올릴 것으로 예상되는 약물을 하나씩 발굴해 다룬다. 이른바 신흥 블록버스터로 떠오른 약물의 탄생과정과 매출 전망 등을 두루 살펴본다.[편집자 주]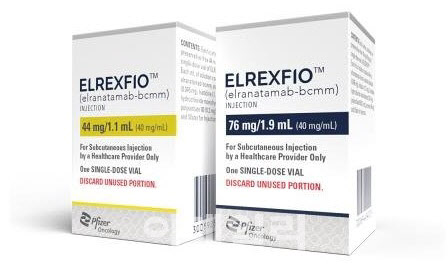 | | 미국 화이자가 개발한 성인 재발성 또는 불응성 다발성 골수종 치료제 ‘엘렉스피오’(성분명 엘라나타맙-bcmm).(제공=화이자) |
|
[이데일리 김진호 기자]미국 화이자가 개발한 성인 재발성 또는 불응성 다발성 골수종 치료제 ‘엘렉스피오’(성분명 엘라나타맙-bcmm)가 지난해 미국과 유럽연합에서 잇따라 승인되며, 해당 질환의 신규 옵션으로 각광받고 있다.
미국 식품의약국(FDA)이 지난해 8월 면역조절제나 항CD38 항체 등 최소 4회 이상 치료 전력이 있는 성인 재발성 불응성 다발성 골수종 치료제로 엘렉스피오를 가속승인했다. 사실상 해당 질환의 5차 치료제로 엘렉스피오를 승인한 것이다. 같은 해 12월 유럽의약품청(EMA)도 엘렉스피오를 같은 적응증으로 엘렉스피오를 조건부 허가했다.
엘렉스피오는 B세포성숙항원(BCMA)와 CD3를 동시에 타깃하는 이중특이항체이며, 화이자는 이를 피하주사(SC) 방식으로 개발하는데 성공했다. BCMA는 B세포 표면에, CD3는 T세포 표면 발현되는 단백질로 알려졌다. 즉 엘렉스피오가 이 두 수용체와 각각 결합해 T세포를 활성화해 다발성 골수종을 일으키는 B세포를 사멸하게 만든다.
화이자에 따르면 엘렉스피오의 임상 2상에서 24주 동안 주1회씩 투여하고, 반응을 보일 경우 격주로 투여했다. 그 결과 BCMA 표준요법제 등 4회 걸친 치료 전력이 있는 63명의 환자 중 84%가 최소 9개월동안 반응을 유지한 것으로 확인된 바 있다. 반응을 보인 환자 가운데 72%가 15개월 동안 유지되기도 했다.
회사는 엘렉스피오에 대해 “장기간 내약성을 보였기 때문에 다발성 골수종 환자가 병원에서 보내는 시간을 줄일 것”이라고 말했다. 현재 일본 의약 당국에서도 엘렉스피오의 허가 심사가 진행 중인 것으로 알려졌다. 국내 식품의약국안전처도 지난해 7월 엘렉스피오를 ‘글로벌 혁신 제품 신속심사제도(GIFT)’의 품목으로 지정해 심사를 진행하고 있다.
엘렉스피오와 동종 계열 치료제로는 미국 얀센의 이중특이항체 신약 ‘테크베일리’(성분명 탈퀴타맙-tgvs)이 있다. 테크베일리 역시 BCMA와 CD3를 통시에 타깃하며, 미국과 유럽에서 각각 2022년 10월과 2023년 7월에 승인됐다. 이밖에 다발성 골수종 환자의 3차 이상 후기 치료제로는 경구약(포말리스트 등)부터 키메릭항원수용체(CAR)-T치료제(아벡마 및 카빅티 등)까지 다양한 약물이 사용되고 있다.





 (좌측상단)
(좌측상단) (우측상단)
(우측상단) (우측상단)
(우측상단)



![난소암 시장 삼킬 ADC '엘라히어' 급부상[블록버스터 톺아보기]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042800070b.jpg)

![[참 고소한 이야기]치매 예방에 탁월한 들기름](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042000024b.jpg)
![[아미코젠 대해부①] 바이오 원료 국산화 선봉장 신용철 아미코젠 의장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/03/PS24032000190b.jpg)

