[이데일리 김새미 기자] “빛은 생물학적으로 가장 정밀한(precise) 에너지 중 하나이다. 이를 항체와 결합, 치료가 필요한 부위에서만 정확하게 활성화하는 방식의 치료를 구현할 수 있다.”
미나미 마에다(Minami Maeda) 라쿠텐메디컬 사장은 자사의 기술에 대해 이렇게 설명했다. 일본 라쿠텐그룹의 미국 자회사 라쿠텐메디컬은 빛을 매개로 세포를 사멸시키는 새로운 항암 모달리티(치료접근법)을 선보이고 있다.
‘알루미녹스’ 항체·빛·기기 결합…새로운 항암 모달리티 라쿠텐메디컬의 ‘알루미녹스’(Alluminox™) 플랫폼은 미국 국립암연구소(National Cancer Institute)의 히사타카 고바야시(Hisataka Kobayashi) 박사팀이 개발했다.
광면역치료(photoimmunotherapy)에 기반한 기술이다. 항체와 빛을 결합한 신개념 항암 모달리티로, 기존 화학요법과 면역항암제의 틀을 넘어선 광(光) 기반 항암 치료의 가능성을 제시하고 있다. 알루미녹스는 약물과 의료기기를 결합한 하이브리드 플랫폼이다. 마에다 사장은 “우리는 항암제 하나를 만드는 회사가 아니라, 항체·빛·기기를 결합한 통합형 모달리티를 구축하고 있다”고 강조했다.
 | | 미나미 마에다 라쿠텐메디컬 사장은 9일 오전 일본 요코하마에서 자사 기술을 시연했다. (사진=김새미 기자) |
|
알루미녹스의 핵심 구성요소는 근적외선(690㎚)에서 활성화하는 광활성 염료 ‘IR700’이다. 이 염료가 암세포 표면을 인식하는 항체에 결합해 종양세포에 달라붙으면 특정 파장의 빛을 쬐는 순간 세포막이 파괴된다. 화학 독성물질을 주입하는 기존 화학 요법과 달리 IR700은 빛을 에너지원으로 삼아 세포를 물리적으로 괴사시키는 방식이다. 이 과정에서 항원이 방출돼 면역세포를 자극하고, 종양 미세환경이 차가운(cold) 상태에서 뜨거운(hot) 상태로 전환되며 면역 반응이 유도된다는 게 마에다 사장의 설명이다.
이 기술은 소형 레이저 장비와 니들 카테터를 활용해 최대 20㎝까지 체내에 주입해 빛을 전달할 수 있다. 시술 전 24시간 전에 약물을 주사하고, 다음 날 빛을 쬐는 방식으로 치료가 이뤄진다. 본격적 시술에 걸리는 시간은 평균 30~90분으로, 일반적으로 15시간 이상 걸리는 전통적인 암 수술보다 짧다. 암 수술에 비해 약물 독성이나 수술적 절제의 부작용 우려도 적다. 국소 마취 또는 전신 마취 후 진행되며, 정상조직 손상이 거의 없어 환자는 수일 내 일상 생활로 복귀할 수 있다. 반복 시술에도 누적 독성이 없고, 환자의 통증·피로감이 적다는 것도 강점이다.
치료 과정에서 발생하는 데이터는 환자별 종양 위치, 조명 강도, 면역 반응과 연동돼 축적된다. 라쿠텐메디컬은 이를 기반으로 향후 ‘약물+의료기기+데이터’가 통합된 디지털 치료 프로토콜을 표준화한다는 계획이다.
임상 통해 日 조건부 허가 넘어 美 FDA 승인 도전 현재 회사는 이 플랫폼을 기반으로 3개의 파이프라인을 보유하고 있다. 두경부암 치료제 ‘ASP-1929’는 2020년 9월 일본 의약품의료기기종합기구(PMDA)의 조건부 승인을 받고 2021년 1월부터 시판 중이며 글로벌 임상 3상 중이다. ‘RM-1995’은 임상 1상 단계에 있으며, ‘RM-0256’은 내년 2분기 임상 1상에 진입할 예정이다.
핵심 파이프라인인 ASP-1929은 두경부 편평세포암 환자 대상 단독 임상 1/2a상 결과 전체생존기간(OS) 9.3개월, 완전관해율(CR) 13.3%, 객관적반응률(ORR) 43.3%, 질병조절률(DCR) 70% 이상인 것으로 나타났다. 마에다 사장은 해당 데이터가 PMDA의 조건부 승인을 결정하는 근거가 됐다고 강조했다.
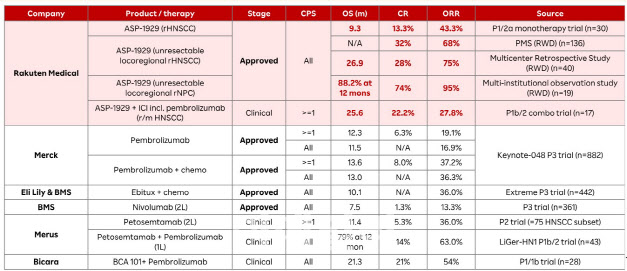 | | 기존 승인 치료제와 ‘ASP-1929’의 임상 데이터 비교 (자료=라쿠텐메디컬) |
|
ASP-1929은 2021년 1월 두경부외과 중심으로 처방을 개시한 이후 누적 치료건수가 1000건을 넘었다. 라쿠텐메디컬은 ASP-1929의 시판 후 조사(PMS) 데이터를 활용해 내년 3분기 최종 승인을 획득할 계획이다.
고무적인 점은 PMS 데이터 중간 분석 결과, 임상 1/2a상 결과를 상회하는 수치가 나왔다는 점이다. 아직 OS는 집계되지 않았지만 ORR은 68.38%, CR 31.62%, 부분관해(PR) 36.76%, 안정병변(SD) 20.59%, 질병진행률(PD) 9.56%로 나타났다. 2021년부터 2024년까지 40명을 대상으로 다기관 후향적 코호트를 분석한 결과 중앙 OS 26.9개월, 1년 생존율 81.4%, 중앙 무진행생존기간(PFS) 6.2개월, 1년 PFS 17.7%, ORR 75% 등을 확인하기도 했다.
특히 ASP-1929를 머크의 면역항암제 ‘키트루다’와 병용할 경우 중앙 OS 25.6개월, ORR 27.8%(이 중 CR은 22.2%), DCR 61.1%로 나타났다. 바이오마커 분석 결과 치료 후 면역원성(immunogenicity)이 관찰됐으며, 면역세포 밀도가 증가해 종양 미세환경이 ‘차가운(cold)’ 상태에서 ‘뜨거운(hot)’ 상태로 전환됐다. 마에다 사장은 병용요법 시 표적 병변 내 항암 면역 활성이 증가된 부분에 주목했다. 그는 이에 대해 “차가운 종양(cold tumor)이 뜨거운 종양(hot tumor)으로 바뀌며 면역계가 깨어난다”며 “면역세포가 계속 자라난다고 보면 된다”며 표현했다.
마에다 사장은 “이 데이터를 통해 임상 3상으로 넘어갈 수 있겠다는 자신감을 얻었다”면서 글로벌 임상 3상의 주평가지표를 OS로 설정했다고 전했다. 라쿠텐메디컬은 FDA 허가를 목표로 2022년 3월 미국, 일본, 대만 등에서 412명을 대상으로 글로벌 임상 3상을 개시했다. 2028년에는 FDA에 신약허가신청서(NDA)를 제출할 예정이다.
후속 파이프라인인 RM-1995와 RM-0256은 알루미녹스를 면역조절 영역으로 확장한다. RM-1995는 조절T세포(Treg)를 억제하는 CD25 항체 기반 치료제이며, RM-0256은 PD-L1을 표적으로 하는 항체와 염료의 접합체다. 후자는 면역관문 억제+세포 사멸+면역억제세포 제거의 3중 기전으로, 면역항암제와 달리 빛의 자극으로 직접 면역 미세환경을 전환한다.
알루미녹스의 확장성…美 아우라 바이오 기술과 차이점은? 알루미녹스는 IR700에 결합 가능한 항체를 교체함으로써 다양한 적응증으로 확장될 여지가 있다. 마에다 사장은 “IR700을 운반할 수 있는 항체만 있다면 모든 종류의 고형암에 적용 가능한 플랫폼을 구축하고 있다”고 자신했다.
한편 이러한 치료접근법을 모색하고 있는 곳이 라쿠텐메디컬만 있는 것은 아니다. 미국 아우라 바이오사이언스(Aura Biosciences)는 IR-700 파생형인 IR-700DX에 바이러스유사입자(VLP)를 결합한 ‘AU-011’을 안구 흑색종 치료제로 개발 중이다. 현재 초기 맥락막 흑색종(choroidal melanoma) 환자를 중심으로 임상 3상 중이며, AU-011의 적응증을 방광암으로 확장하기 위해 2022년 1월 임상 1상도 개시했다.
단 아우라 바이오는 IR-700DX만 보유하고 있고, 라쿠텐메디컬은 지난 2월 미국 라이코 바이오사이언스(LI-COR Biosciences)로부터 IR-700의 원천 기술과 생산권을 모두 확보했기 때문에 권리 관계가 다르다. 두 물질의 화학적 구조와 용도도 다르다. IR-700DX는 IR-700에 N-하이드록시석신이미드 에스터기(NHS ester기)를 부착해 단백질에 화학적 결합이 용이하게 변형했다.
마에다 사장은 “라이코가 초반에는 여러 곳에 IR700을 공급했다”며 “지금은 라쿠텐메디컬이 라이코로부터 애셋을 인수했기 때문에 다른 회사들이 IR700을 사용하는 경우도 있지만 그들에게 우리가 IR700을 공급하고 있다고 보면 된다”고 언급했다.